アプリケーション セルベース分子間相互作用解析装置 LigandTracerシリーズ

アプリケーション
LigandTracerのアプリケーションをご紹介します。
知りたいこと(得られる情報)から選ぶ
❶ 結合親和性とカイネティクス
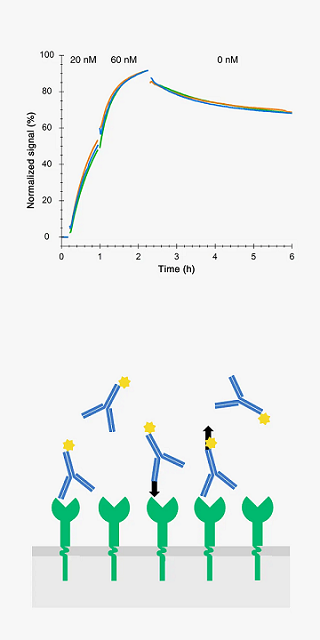
リガンドの結合親和性と結合/解離カイネティックスは、リード医薬品のランキング、放射性トレーサーの開発、リガンド-受容体システムの理解に重要なデータです。
実験で得られたデータをモデルカーブにフィッティングさせることで様々な数値データと知見を得ることができます。
得られる情報
- 親和性(KD)
- 結合速度定数(ka)と解離速度定数(kd)
- 結合滞留時間(t1/2)
- 結合モードの変化
- 受容体の結合飽和におけるリガンド濃度
(右図上のデータ)
Accurate estimations of the binding kinetics and affinity are typically obtained from curves with two incubation phases and one wash-out phase. Here FITC-Rituximab binding to anchored B-cells (n=4).
| 関連資料 | |
|---|---|
| プロトコル | A typical LigandTracer measurement |
| プロトコル | A typical LigandTracer measurement with MultiDish 2x2 |
| 参考論文 | |
|---|---|
Real-time characterization of antibody binding to receptors on living immune cells.
Bondza S, Foy E, Brooks J, Andersson K, Robinson J, Richalet P, Buijs J. | |
Development of human monoclonal antibody for Claudin-3 overexpressing carcinoma targeting.
Yang H, Park H,Jin Lee Y, Young Choi J, Kim TE, Rajasekaran N, Lee S, Song K, Hong S, Choi J-S, Shim H, Kim Y-D, Hwang S, Choi Y-L, Kee Shin Y. | |
Brain delivery of biologics using a cross‐species reactive transferrin receptor 1 vnar shuttle.
Sehlin D, Stocki P, Gustavsson T, Hultqvist G, Walsh FS, Rutkowski JL, Syvänen S. |
❷ 標的分子への結合特異性
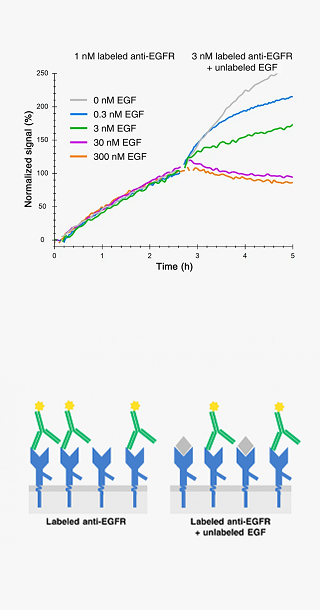
ラベル化したリガンドの標的分子への結合特異性の検証は、分子標的治療薬開発における生体内分布試験や分子イメージングプローブの開発において重要です。
この結合特異性試験は、標的分子を発現する細胞と発現しない細胞で同一条件下で実験を行って比較したり、非標識のリガンドと標識リガンド一緒に作用させて競合阻害させることで行います。
標識したリガンドが本来の非標識リガンドと同じエピトープを持つと、競争阻害により、非標識リガンドの濃度依存的にシグナルが低下します。
あるいはクエンチャーでラベルしたリガンドを用いて実験を行うと、近接するエピトープに結合しているかどうかを調べることができます(クエンチャー実験は蛍光を検出するLigandTracer Greenでのみ可能です)。
得られる情報
- 細胞株によるリガンド結合性の比較
- リガンドの標的結合特異性
- エピトープマッピング -競争阻害
- エピトープマッピング -エピトープの近接
(右図上のデータ)
By disrupting an interaction with a non-labeled competitor you not only get insight about shared epitopes, but you can also extract information on the kinetics and affinity of both ligands.
| 関連資料 | |
|---|---|
| アプリケーションノート | LigandTracer MultiDish Increasing throughput and simplifying comparison |
| アプリケーションノート | Multiple cell line assay in a single LigandTracer run |
| 参考論文 | |
|---|---|
Technical Aspect of the Automated Synthesis and Real-Time Kinetic Evaluation of [11C]SNAP-7941.
Vraka C, Pichler V, Pfaff S, Balber T, Hacker M, Mitterhauser M, Wadsak W, Philippe C. | |
A novel real-time proximity assay for characterizing multiple receptor interactions on living cells.
Bondza S, Björkelund H, Nestor M, Andersson K, Buijs J. |
❸ 受容体のクラスタリングとダイマー化
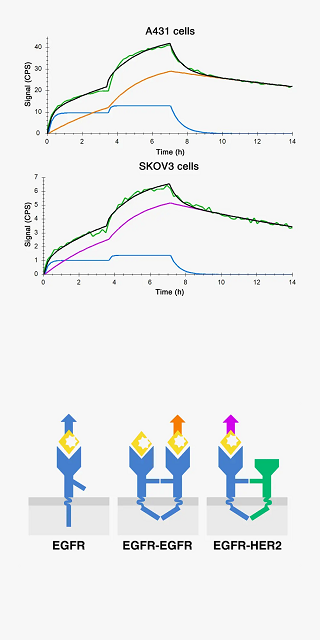
リガンドと標的分子(受容体)の親和性や結合カイネティクスは、受容体がダイマー化したり、クラスターを作ることにより影響を受けます。
この受容体のクラスター形成やダイマー形成を知ることで、リガンド-受容体システムをより深く理解することが可能です。
リガンド結合の経時的データを追跡することで、リガンド(薬剤)によってもたらされる(あるいは阻害される)受容体のクラスター化とダイマー化を解析することができます。
あるいは、クエンチャー標識したリガンドを混合して実験を行うことで、受容体のクラスター化やダイマー化の結果起こるリガンド同士の近接を調べることができます(クエンチャー実験は蛍光を検出するLigandTracer Greenでのみ可能です)。
得られる情報
- 受容体のクラスター形成やダイマー形成によりもたらされるリガンド分子の接近
- 薬剤による引き起こされる受容体のクラスター形成やダイマー形成(あるいはその逆:脱クラスター化やモノマー化)
- 受容体密度がクラスター形成やダイマー形成に与える影響
- Avidity(1分子あたり2つ以上の結合部位があること)の影響
(右図上のデータ)
By fitting the curve (green) to a model (black) it is possible to decipher the binding of EGF to EGFR monomers (blue), EGFR homodimers (orange) and EGFR-HER2 heterodimers (purple). The dimer ratios affect the overall binding and depend on hosting cell lines and their receptor population.
| 関連資料 | |
|---|---|
| アプリケーションノート | LigandTracer MultiDish Increasing throughput and simplifying comparison |
| 参考論文 | |
|---|---|
A novel real-time proximity assay for characterizing multiple receptor interactions on living cells.
Bondza S, Björkelund H, Nestor M, Andersson K, Buijs J. | |
Björkelund H, Gedda L, Barta P, Malmqvist M, Andersson K. |
❹ 薬剤修飾分子(コンジュゲート)のキャラクタライゼーション
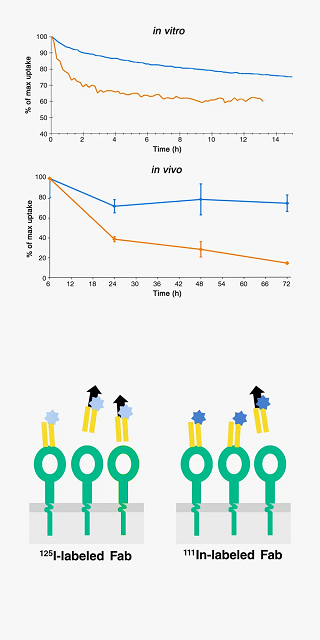
抗体薬物複合体(ADC)、光がん免疫療法などの薬剤(治療法)は、オリジナルの抗体に第2の分子を結合させることにより機能します。あるいは、放射性トレーサーや光イメージングプローブは、オリジナルの分子を放射性元素で修飾することで得られます。
LigandTracerのデータからオリジナル分子の修飾(コンジュゲート)による影響を詳細に知ることができます。より適した修飾分子の選択などに役立つ情報を得られます。
得られる情報
- 修飾(コンジュゲート)の親和性への影響
- 修飾(コンジュゲート)の結合カイネティクスへの影響
- 放射性トレーサーのin vitroでの解析
- 結合様式の変化の予測
- バッチ間変動
- リガンドの不均一性
(右図上のデータ)
A Fab fragment under development for imaging was labeled with 125I (orange) and 111In (blue) and added to A431 cells as monolayers in LigandTracer (in vitro) or as tumor xenografts in mice (in vivo). A significantly higher retention of 111In-Fab was observed both in vitro and in vivo.
| 関連資料 | |
|---|---|
| プロトコル | Direct labeling with 125I |
| プロトコル | Indirect labeling of protein with 125I |
| プロトコル | Protein labeling with FITC |
| 参考論文 | |
|---|---|
Garousi J, Huizing FJ, Vorobyeva A, Mitran B, Andersson KG, Dahlsson Leitao C, Frejd FY, Löfblom J, Bussink J, Orlova A, Heskamp S, Tolmachev V. | |
Mortensen AC, Spiegelberg D, Haylock AK, Lundqvist H, Nestor M. |
❺ 結合親和性への温度の影響
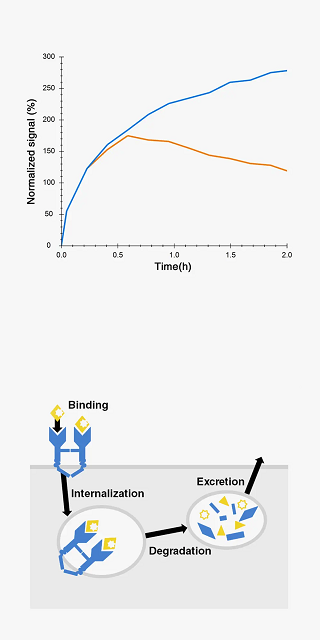
温度による相互作用の強さやカイネティクスの変化を調べます。
室温で測定することで受容体インタナリゼーションなどの細胞本来のプロセスが損なわれます。一方、37℃でアッセイすることでインビボと同じ状況の細胞レスポンスを得られます。
pH感受性色素あるいは放射性ラベルなど、インタナリゼーションにより放出されるラベル法を使って実験を行います。
得られる情報
- 親和性への温度の影響
- 結合カイネティクスへの温度の影響
- 受容体インタナリゼーションの兆候
- 受容体インタナリゼーションと分解あるいは細胞死によるラベル核種の放出
(右図上のデータ)
The binding curve of 125I-EGF to A431 cells at 37 °C shows the excretion of 125I (t > 0.5 h) caused by 125I-EGF internalization and subsequent EGF degradation (orange). At room temperature no signal decrease is observed, suggesting minimal internalization and/or degradation (blue).
| 参考論文 | |
|---|---|
Björkelund H, Gedda L, Malmqvist M, Andersson K. | |
Bugaytsova JA et al. | |
Effect of clofarabine on apoptosis and DNA synthesis in human epithelial colon cancer cells.
Wang X, Albertioni F. | |
Crispim Encarnação J, Napolitano V, Opassi G, Danielson HU, Dubin G, Popowicz GM, Munier‐Lehmann H, Buijs J, Andersson K, Björkelund H. |
❻ リガンド結合と機能
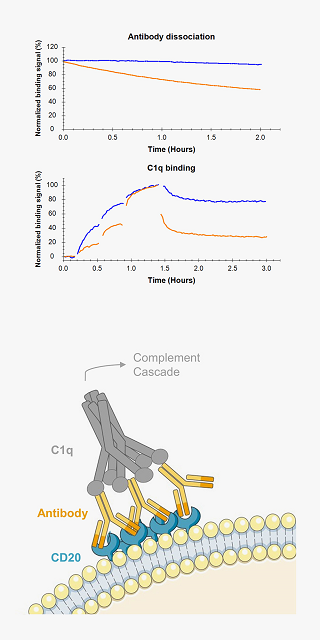
受容体へのリガンド結合は細胞内シグナル伝達系の引き金です。
リガンド結合の時間的変化と異なる実験処理間におけるリガンド結合性の違いを解析することで細胞機能につながる重要な知見を得ることができます。
リガンド結合の安定性や2価性のような結合特性と機能の変化の相関を知ることは、重要な生物学的プロセスがどのように引き起こされるのか知るきっかけとなります。
得られる情報
- リガンド結合の時間的変化
- リガンド結合と機能の相関
- シグナル伝達系の引き金として働くリガンド結合に関する情報
- If/how binding influences magnitude of biological signal
(右図上のデータ)
The CD20 targeting therapeutic antibodies Ofatumumab (blue) and Rituximab (orange) differ in their binding stability to Ramos cells (upper panel). The first component of the complement system, C1q is binding more stable to cells coated with Ofatumumab (blue) compared to cells with Rituximab (orange) (lower panel). The differences in antibody binding stability is thus reflected in the interaction of C1q with antibody opsonized cells and match with the known superior complement activation capability of Ofatumumab.
| 参考論文 | |
|---|---|
Transitional changes in the CRP structure lead to the exposure of proinflammatory binding sites.
Braig D, Nero T L, Koch HG, Kaiser B, Wang X, Thiele JR, Morton CJ, Zeller J, Kiefer J, Potempa LA, Mellett NA, Miles LA, Du XJ, Meikle PJ, Huber-Lang M, Stark GB, Parker MW, Peter K, Eisenhardt SU. | |
Bondza S, Marosan A, Kara S, Lösing J, Peipp M, Nimmerjahn F, Buijs J, Lux A. |
測定ターゲットから選ぶ
❶ 接着細胞
接着細胞はLigandTracerの実験で最も一般的な測定対象です。
細胞膜に発現するタンパク質、特に受容体に対するリガンド結合親和性や結合の時間的変化を調べます。細胞は温度変化によって機能を変え、例えば受容体のインタナリゼーションや分解のプロセスは温度によってオン/オフされます。そのような事象やリガンド結合に伴う受容体のクラスター化、ダイマー化などを調べることで、細胞機能につながる知見を得ることができます。
通常のペトリディッシュを使って実験を行います。あるいはLigandTracer Greenでは 2x2 マルチディッシュを使用可能、実験群間の比較が容易になります。
主なアプリケーション
- リガンドの結合親和性と結合カイネティクス
- 標識リガンドの結合特異性
- 受容体のクラスター化とダイマー形成
- 薬剤コンジュゲートのキャラクタリゼーション
- リガンド結合への温度の影響(受容体インタナリゼーションや分解)
| 関連資料 | |
|---|---|
| プロトコル | Seeding cells for LigandTracer |
| プロトコル | Seeding cells in cell culture Multidish 2x2 |
| プロトコル | Coat with polydopamine to enhance cell adhesion |
| プロトコル | Seeding cells in polydopamine coated dishes |
| 参考論文 | |
|---|---|
Feasibility of Imaging EpCAM Expression in Ovarian Cancer Using Radiolabeled DARPin Ec1.
Vorobyeva A, Konovalova E, Xu T, Schulga A, Altai M, Garousi J, Rinne SS, Orlova A, Tolmachev V, Deyev S. | |
Meyer S, Evers M, Jansen JHM, Buijs J, Broek B, Reitsma SE, Moerer P, Amini M, Kretschmer A, Ten Broeke T, den Hartog MT, Rijke M, Klein C, Valerius T, Boross P, Leusen JHW. |
❷ 浮遊細胞
血液がんあるいは免疫疾患が高い治療ニーズを持ちます。
生きた免疫細胞で免疫受容体などへのリガンド結合特性を知ることで、創薬あるいは免疫系機能に関しての知見を得ます。
浮遊細胞をディッシュ底面に接着させるには推奨のアンカー分子でディッシュをコートします。通常の市販ペトリディッシュあるいはコート用の 2x2マルティディッシュを使用できます。自前で用意された固相化試薬をお使いいただくこともできます。
主なアプリケーション
- リガンドの結合親和性と結合カイネティクス
- 標識リガンドの結合特異性
- 受容体のクラスタ―化とダイマー形成
- 薬剤コンジュゲートのキャラクタリゼーション
- リガンド結合への温度の影響(受容体インタナリゼーションや分解)
| 関連資料 | |
|---|---|
| プロトコル | Attaching suspension cells for LigandTracer measurements |
| 参考論文 | |
|---|---|
Real-time characterization of antibody binding to receptors on living immune cells.
Bondza S, Foy E, Brooks J, Andersson K, Robinson J, Richalet P, Buijs J. |
❸ バクテリア
抗細菌薬の結合親和性、結合カイネティクス、結合特異性を調べます。あるいは色素タンパク質の発現解析を通じて細胞内プロセスを調べるアプリケーションもあります。
バクテリアは様々な環境要因に対して高い耐性を持ちます。低pH、低温などの環境変化の際のリガンド結合や結合カイネティクスの変化は細菌学に新たな知見をもたらします。
ディッシュ底面への最近の固相化については 我々の論文をご参照ください。
主なアプリケーション
| 参考論文 | |
|---|---|
Detecting ligand interactions in real time on living bacterial cells.
Crispim Encarnação J, Schulte T, Achour A, Björkelund H, Andersson K. |
❹ 組織
組織切片をガラスディッシュに貼り付けることで、組織上のタンパク質に対するリアルタイムのリガンド結合実験を行います。
組織タンパク質とリガンドの結合の経時的な測定が相互作用の知見を深めます。また、インキュベーション時間や抗体濃度など免疫組織学実験の最適化も可能です。
組織切片ではなく新鮮組織を使った実験を行うことも可能で、FDGの組織へのリアルタイム取り込み実験など代謝に関わる研究が可能です。
主なアプリケーション
- リガンドの結合親和性と結合カイネティクス
- 標識リガンドの結合特異性
- 免疫組織化学プロトコルの最適化
- 代謝のリアルタイム測定
- 結合不均一性の解析
| 関連資料 | |
|---|---|
| アプリケーションノート | Monitoring protein-tissue interactions in real-time |
| プロトコル | Preparations for tissue measurements in LigandTracer |
| 参考論文 | |
|---|---|
Gedda L, Björkelund H, Lebel L, Asplund A, Dubois L, Wester K, Penagos N, Malmqvist M, Andersson K. | |
Magnone M, Emionite L, Guida L, Vigliarolo T, Sturla L, Spinelli S, Buschiazzo A, Marini C, Sambuceti G, De Flora A, Orengo AM, Cossu V, Ferrando S, Barbieri O, Zocchi E. | |
Obligatory role of endoplasmic reticulum in brain FDG uptake.
Cossu V, Marini C, Piccioli P, Rocchi A, Bruno S, Orengo AM, Emionite L, Bauckneht M, Grillo F, Capitanio S, Balza E, Yosifov N, Castellani P, Caviglia G, Panfoli I, Morbelli S, Ravera S, Benfenati F, Sambuceti G. |
❺ タンパク質

標的タンパク質が細胞表面に発現していない場合は精製タンパク質を用いた相互作用解析が適しています。
抗体医薬品などのクォリティコントロールにも使用することができます。
精製タンパク質のディッシュ底面への固相化は様々な方法で実施できます。詳しくは下記のプロトコルやアプリケーションノートをご覧ください。
主なアプリケーション
- リガンドの結合親和性と結合カイネティクス
- 濃度定量
- 標識リガンドの結合特異性
- 修飾分子のリガンドへの影響
- 医薬品QCにおけるバッチコントロール
| 関連資料 | |
|---|---|
| アプリケーションノート | Protein-protein interactions measured with LigandTracer |
| プロトコル | Adsorb protein to a polystyrene dish |
| 参考論文 | |
|---|---|
Gustavsson T, Syvänen S, O’Callaghan P, Sehlin D. | |
Automated functional characterization of radiolabeled antibodies: a time-resolved approach.
Wang E, Björkelund H, Mihaylova D, Hagemann UB, Karlsson J, Malmqvist M, Buijs J, Abrahmsén L, Andersson K. |
❻ ナノ粒子

分子の吸収と放出をモニタリングすることでナノ粒子のキャラクタライゼーションを行うことができます。分子の濃度やバッファー組成を変えてその結果を評価します。
LigandTracerは放出の遅い分子でも安定した信頼性の高い測定が可能です。
主なアプリケーション
- ナノ粒子への分子の吸収と放出の追跡
- 濃度依存性の評価
- ナノ粒子の性能評価
- 物理化学的条件の影響の探査
| 参考論文 | |
|---|---|
Guided growth of auditory neurons: Bioactive particles towards gapless neural – Electrode interface.
Li H, Edin F, Hayashi H, Gudjonsson O, Danckwardt-Lillieström N, Engqvist H, Rask-Andersen H, Xia W. | |
Pazik R, Andersson R, Kepinski L, Nedelec JM, Kessler VG, Seisenbaeva GA. |
リガンドの種類から選ぶ
❶ 抗体、タンパク質、ペプチド
タンパク質やペプチドは生体内で主要な情報伝達因子として働きます。それらと受容体との結合と解離のプロセスを正確な理解することは、大切な生物学的プロセスの解明につながります。
創薬においては、高分子医薬品(抗体医薬品、タンパク製剤)やペプチド医薬品、あるいは抗体薬物複合体(ADC)の標的分子に対する結合親和性や結合カイネティクスを詳細に知ることは、開発候補医薬品の選定やキャラクタライゼーションに欠かせない要素です。
LigandTracerは、膜タンパク質を標的とするこれらの医薬品の結合特性をセルベースでリアルタイムに測定することを可能にします。
主なアプリケーション
- リガンドの結合親和性と結合カイネティクス
- 標識リガンドの結合特異性
- 受容体のクラスター化とダイマー形成
- 薬剤コンジュゲートのキャラクタリゼーション
- リガンド結合への温度の影響(受容体インタナリゼーションや分解)
| 関連資料 | |
|---|---|
| プロトコル | Protein labeling with FITC |
| プロトコル | Direct labeling with 125I |
| プロトコル | Indirect labeling of protein with 125I |
| 参考論文 | |
|---|---|
Bivalent binding on cells varies between anti-CD20 antibodies and is dose-dependent.
Bondza S, Ten Broeke T, Nestor M, Leusen JHW, Buijs J. | |
Garousi J, Huizing FJ, Vorobyeva A, Mitran B, Andersson KG, Dahlsson Leitao C, Frejd FY, Löfblom J, Bussink J, Orlova A, Heskamp S, Tolmachev V. | |
Mitran B, Güler R, Roche FP, Lindström E, Selvaraju RK, Fleetwood F, Rinne SS, Claesson-Welsh L, Tolmachev V, Ståhl S, Orlova A, Löfblom J. |
❷ 低分子
低分子化合物は、バイオ医薬品が主流の現代においてもなお大切な医薬モダリティで、多くの低分子医薬品が新薬として開発されています。
また多くの場合、FDGに代表されるPET/SPECTイメージングプローブにも合成化合物が使われます。
LigandTracerでは、14C, 18Fなどの放射性同位元素で低分子化合物の一部を置き換えることでこれらの合成化合物をラベルし、標的分子に対する親和性や結合カイネティクスを測定します。放射性同位ラベルは、分子量の小さい化合物でも、その特性に影響を与えずに実験が可能です。
主なアプリケーション
- リガンドの結合親和性と結合カイネティクス
- 標識リガンドの結合特異性
- 細胞におけるDNA合成の測定
- 放射性トレーサーのキャラクタライゼーション
- リガンド結合への温度の影響
| 関連資料 | |
|---|---|
| アプリケーションノート | Detecting real-time DNA synthesis using LigandTracer White |
| 参考論文 | |
|---|---|
Berroterán-Infante N, Balber T, Fürlinger P, Bergmann M, Lanzenberger R, Hacker M, Mitterhauser M, Wadsak W. | |
Cossu V, Bauckneht M, Bruno S, Orengo AM, Emionite L, Balza E, Castellani P, Piccioli P, Miceli A. Raffa S, Borra A, Donegani MI, Carlone S, Morbelli S, Ravera S, Sambuceti G, Marini C. |
❸ ナノ粒子

リポソーム、ミセル、細胞外小胞、エクソソームなど細胞に作用しうるナノ粒子には様々なタイプのものがあります。
LigandTracerは、細胞へのこれらのナノ粒子の取り込みと保持を、生細胞を用いてリアルタイムに測定することができます。
ナノ粒子そのものだけでなく医薬品を包含させたナノDDS製剤の細胞への取り込み実験にも適しています。
主なアプリケーション
- ナノ粒子の細胞への取り込み速度の解析
- ナノ粒子の細胞への取り込みの特異性解析
- ナノ粒子の組成の違いによる比較
- 薬剤包含ナノ粒子の細胞への取り込みと放出の解析
- 温度条件のナノ粒子取り込みと細胞内保持への影響の解析
| 参考論文 | |
|---|---|
Tumor-Targeted Delivery of the p53-Activating Peptide VIP116 with PEG-Stabilized Lipodisks.
Lundsten S, Agmo Hernández V, Gedda L, Sarén T, Brown CJ, Lane DP, Edwards K, Nestor M. | |
Krishnan AK, Pant T, Sankaranarayan S, Stenberg J, Jain R, Dandekar P. | |
Lie Z, Xie J, Peng S, Liu S, Wang Y, Lu W, Shen J, Li C. |
❹ ウイルス、バクテリア、細胞
リガンドは常に分子とは限りません。
ウイルス、細菌なども最適なラベルをすることで、細胞への取り込み(感染)をLigandTracerでモニターすることができます。あるいはエフェクター細胞をラベルすることで、細胞-細胞間相互作用を調べることも可能かもしれません。
細胞製剤や遺伝子治療薬など躍進する新たな医薬モダリティの開発においてお役立ていただけるアプリケーションです。
主なアプリケーション
- ウイルス粒子や細菌の宿主細胞への取り込みと細胞内の滞留
- 二重特異性抗体の評価
- 遺伝子改変T細胞(CAR-Tなど)の標的細胞への作用
| 参考論文 | |
|---|---|
Yu D, Jin C, Leja J, Majdalani N, Nilsson B, Eriksson F, Essand M. | |
T4SS-dependent TLR5 activation by Helicobacter pylori infection
Pachathundikandi SK, Tegtmeyer N, Arnold IC, Lind J, Neddermann M, Falkeis-Veits C, Chattopadhyay S, Bronstrup M, Tegge W, Hong M, Sticht H, Vieth M, Muller A, Backert S. | |
Brandsma AM, Bondza S, Evers M, Koutstaal R, Nederend M, Jansen M, Rösner T, Valerius T, Leusen JHW, Broeke T. |
製品/シリーズに関するお問い合わせ
製品に関するご質問や技術的なお問い合わせなどはこちらのフォームをご利用ください。